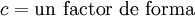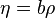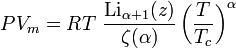INTRODUCCIÓN
Las ecuaciones de estado son útiles para describir las propiedades de los
fluidos,
mezclas,
sólidos o incluso del interior de las
estrellas. Cada substancia o sistema hidrostático tiene una ecuación de estado característica dependiente de los niveles de energía moleculares y sus energías relativas, tal como se deduce de la
mecánica estadística.
El uso más importante de una ecuación de estado es para predecir el estado de gases. Una de las ecuaciones de estado más simples para este propósito es la
ecuación de estado del gas ideal, que es aproximable al comportamiento de los gases a bajas presiones y temperaturas mayores a la
temperatura crítica. Sin embargo, esta ecuación pierde mucha exactitud a altas presiones y bajas temperaturas, y no es capaz de predecir la condensación de gas en líquido. Por ello, existe una serie de ecuaciones de estado más precisas para gases y líquidos. Entre las ecuaciones de estado más empleadas sobresalen las
ecuaciones cúbicas de estado. De ellas, las más conocidas y utilizadas son la
ecuación de Peng-Robinson (PR) y la
ecuación de Redlich-Kwong-Soave (RKS). Hasta ahora no se ha encontrado ninguna ecuación de estado que prediga correctamente el comportamiento de todas las sustancias en todas las condiciones.
Además de predecir el comportamiento de gases y líquidos, también hay ecuaciones de estado que predicen el volumen de los
sólidos, incluyendo la transición de los sólidos entre los diferentes estados cristalinos. Hay ecuaciones que modelan el interior de las
estrellas, incluyendo las
estrellas de neutrones. Un concepto relacionado es la ecuación de estado del
fluido perfecto, usada en
Cosmología.
Modelo Matemático de estado más usadas
Analizando el comportamiento de los gases que se puede observar en los diagramas PνT o Pν, se han propuesto muchos modelos matemáticos distintos que se aproximan a dicho comportamiento. Sin embargo, estos modelos no pueden predecir el comportamiento real de los gases para todo el amplio espectro de presiones y temperaturas, sino que sirven para distintos rangos y distintas sustancias. Es por eso que, según las condiciones con las cuales se esté trabajando, conviene usar uno u otro modelo matemático.
En las siguientes ecuaciones las variables están definidas como aparece a continuación; se puede usar cualquier sistema de unidades aunque se prefieren las unidades del
Sistema Internacional de Unidades:
- P = Presión (atmósferas)
- V = Volumen
- n = Número de moles
- ν = V/n = Volumen molar, el volumen de un gmol de gas
- T = Temperatura (K)
- R = constante de los gases (8,314472 J/mol·K) o (0,0821 atm·L/gmol·K)
-
- Modelo Matemático Ideal - Ley del gas ideal
La ecuación de los gases ideales realiza las siguientes aproximaciones:
- Considera que las moléculas del gas son puntuales, es decir que no ocupan volumen.
- Considera despreciables a las fuerzas de atracción-repulsión entre las moléculas.

ν es el volumen específico, que se define como el volumen total sobre la masa (con unidades en gramos, kilogramos, libras, etc.) o como el volumen total sobre la cantidad de materia (medida en gramos moles, libras moles, etc.). El primero se denomina volumen específico másico y el segundo volumen específico molar. Para la expresión anterior se utiliza el volumen específico molar. Si se quiere expresar en función del volumen total, se tiene
PV = nRT
Además, puede expresarse de este modo

donde
ρ es la densidad,
γ el índice adiabático y
u la energía interna. Esta expresión está en función de magnitudes intensivas y es útil para simular las
ecuaciones de Euler dado que expresa la relación entre la energía interna y otras formas de energía (como la cinética), permitiendo así simulaciones que obedecen a la Primera Ley.
Restricciones del modelo ideal
La ecuación de los gases ideales no tiene buena correlación con el comportamiento de los gases reales. Al considerar el volumen molecular y las fuerzas de atracción-repulsión despreciables, no es fiable cuando el volumen es pequeño o la temperatura es baja, ya que los factores que se despreciaron influyen más. Es por eso que se la utiliza a altas temperaturas (la energía cinética de las moléculas es alta comparada con las fuerzas de atracción-repulsión) y bajas presiones (el volumen es muy grande comparado con el volumen de las moléculas del gas). En general el criterio utilizado es que se puede utilizar dicha ecuación cuando la temperatura a la que se está trabajando (o el rango de temperaturas) es superior a dos veces la temperatura crítica del compuesto.
En la gráfica Pν, la zona de temperaturas superior a dos veces la temperatura crítica corresponde a las isotermas que superan a la isoterma crítica. Al estar tan lejos de la campana húmeda del gráfico, las curvas isotérmicas se aproximan a la forma que tienen en el gráfico Pν para los gases ideales. En dicho gráfico, la pendiente de las curvas isotérmicas se puede sacar haciendo la derivada parcial de la presión en función del volumen específico molar, quedando lo siguiente:
Teniendo en cuenta el módulo de la derivada, y considerando sólo el primer cuadrante, nos quedan isotermas similares a las de la imagen a continuación:
El factor de compresibilidad z
Si bien hay muchos modelos matemáticos distintos, todos de pueden generalizar mediante la siguiente expresión:
z es lo que se denomina factor de compresibilidad, que representa cuán alejado estamos del modelo ideal de los gases. Si z vale 1, entonces el modelo ideal es aplicable. Sin embargo, los valores de z pueden variar entre 0 y 1, e incluso puede tomar valores mayores a 1. La desviación z se puede calcular con cualquiera de los modelos matemáticos. De la ecuación anterior sale que

Si se resuelve lo anterior para los distintos modelos, se puede hallar z. Según qué modelo estemos usando, el z expresará la desviación de
ese modelo respecto al modelo ideal. Si estamos trabajando a cierta presión y temperatura, tendremos cierto valor de volumen específico. Si tenemos una medición experimental del volumen específico, podemos expresar

donde ν
i es el volumen específico molar ideal y ν
r el volumen específico molar real (medido). La expresión anterior sirve también para hallar z usando el volumen específico calculado con el modelo ideal y el calculado con otro de los modelos matemáticos.
Modelo Matemático de Van der Waals
La ecuación de Van der Waals es una ecuación que generaliza la ecuación de los gases ideales, haciendo entrar en consideración tanto el volumen finito de las moléculas de gas como otros efectos que afectan al término de presiones. Tiene la forma:
Nótese que
ν es el volumen molar. En esta expresión, a, b y R son constantes que dependen de la sustancia en cuestión. Pueden calcularse a partir de las
propiedades críticas de este modo: De la gráfica Pv, podemos observar que el punto crítico (para cada compuesto) presenta las siguientes características:
- Es un máximo, ya que es el punto mayor de la campana, por lo que la derivada primera en ese punto, al tratarse de un extremo, debe ser cero.
- Es un punto de inflexión de la isoterma crítica, ya que en ese punto dicha isoterma cambia de concavidad, por lo que la derivada segunda en ese punto debe ser cero.
De las dos condiciones de arriba, y como el punto crítico pertenece tanto a la campana como a la isoterma crítica, podemos sacar dos ecuaciones:


ambas evaluadas en el punto crítico, o sea usando valores de temperatura, presión y volumen específico críticos. De esta forma podemos despejas a y b de las ecuaciones, ya que tenemos 2 ecuaciones y 2 incógnitas (conocemos las propiedades críticas de los compuestos). Si resolvemos, nos queda lo siguiente:

Si además usamos la siguiente ecuación, que es válida en utilizando las propiedades críticas para hallar el z crítico, cuyo valor coincide para la misma familia de gases,
Si reemplazamos el volumen crítico por la relación de arriba, llegamos a las ecuaciones de a y b:

La
ecuación de Van der Waals fue una de las primeras que describía el comportamiento de los gases visiblemente mejor que la ley del gas ideal. En esta ecuación
a se denomina el parámetro de atracción y
b el parámetro de repulsión o el volumen molar efectivo. Mientras que la ecuación es muy superior a la ley del gas ideal y predice la formación de una fase líquida, sólo concuerda con los datos experimentales en las condiciones en las que el líquido se forma. Mientras que la ecuación de Van der Waals se suele apuntar en los libros de texto y en la documentación por razones históricas, hoy en día está obsoleta. Otras ecuaciones modernas sólo un poco más difíciles son mucho más precisas.
La ecuación de Van der Waals puede ser considerada como la "ley del gas ideal mejorada", por las siguientes razones:
- Trata a las moléculas como partículas con volumen, no como puntos en el espacio. Por ello V no puede ser demasiado pequeño, y se trabaja con (V - b) en lugar de V.
- Mientras que las moléculas del gas ideal no interaccionan, Van der Waals considera que unas moléculas atraen a otras dentro de una distancia equivalente al radio de varias moléculas. No provoca efectos dentro del gas, pero las moléculas de la superficie se ven atraídas hacia el interior. Se ve esto al disminuir la presión exterior (usada en la ley del gas ideal), y por ello se escribe (P + algo) en lugar de P. Para evaluar este 'algo', se examina la fuerza de atracción actuando en un elemento de la superficie del gas. Mientras que la fuerza que actúa sobre cada molécula superficial es ~ρ, la resultante sobre el elemento completo es ~ρ2~

Modelo Matemático del Virial


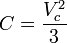

Aunque generalmente no es la ecuación de estado más conveniente, la ecuación del Virial es importante dado que puede ser obtenida directamente por
mecánica estadística. Si se hacen las suposiciones apropiadas sobre la forma matemática de las fuerzas intermoleculares, se pueden desarrollar expresiones teóricas para cada uno de los coeficientes. En este caso
B corresponde a interacciones entre pares de moléculas,
C a grupos de tres, y así sucesivamente...
Modelo Matemático de Redlich-Kwong
Donde


 = constante de los gases (8.31451 J/mol·K)
= constante de los gases (8.31451 J/mol·K)
Introducida en
1949, la ecuación de Redlich-Kwong fue una mejora considerable sobre las otras ecuaciones de la época. Aún goza de bastante interés debido a su expresión relativamente simple. Aunque es mejor que la ecuación de Van der Waals, no da buenos resultados sobre la fase líquida y por ello no puede usarse para calcular precisamente los equilibrios líquido-vapor. Sin embargo, puede usarse conjuntamente con expresiones concretas para la fase líquida en tal caso.
La ecuación de Redlich-Kwong es adecuada para calcular las propiedades de la fase gaseosa cuando el cociente entre la presión y la presión crítica es menor que la mitad del cociente entre la temperatura y la temperatura crítica.
Modelo Matemático de Soave

- R = Constante de los gases (8,31451 J/(K·mol))



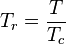
para el hidrógeno:
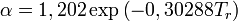
En
1972 Soave reemplazó el término
a/√(
T) de la ecuación de Redlich-Kwong por una expresión α(T,ω) función de la temperatura y del
factor acéntrico. La función α fue concebida para cuadrar con los datos de las presiones de vapor de los hidrocarburos; esta ecuación describe acertadamente el comportamiento de estas sustancias.
Modelo Matemático de Peng-Robinson

- R = constante de los gases (8,31451 J/mol·K)

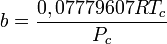

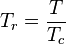
Donde ω es el factor acéntrico del compuesto.
La ecuación de Peng-Robinson fue desarrollada en
1976 para cumplir los siguientes objetivos:
- Los parámetros habían de poder ser expresados en función de las propiedades críticas y el factor acéntrico.
- El modelo debía ser razonablemente preciso cerca del punto crítico, particularmente para cálculos del factor de compresibilidad y la densidad líquida.
- Las reglas de mezclado no debían emplear más que un parámetro sobre las interacciones binarias, que debía ser independiente de la presión, temperatura y composición.
- La ecuación debía ser aplicable a todos los cálculos de todas las propiedades de los fluidos en procesos naturales de gases.
Generalmente la ecuación de Peng-Robinson da unos resultados similares a la de Soave, aunque es bastante mejor para predecir las densidades de muchos compuestos en fase líquida, especialmente los apolares.
R = constante de los gases (8,31451 J/mol·K)
Modelo Matemático de Beattie-Bridgeman
Este es un modelo de 5 constantes, cuyas ecuaciones son las siguientes



Por consiguiente, las 5 constantes son
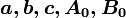
Ecuación de Benedict-Webb-Rubin
Esta modelización realizada en 1940 especialmente para hidrocarburos livianos y las mezclas de los mismos también es denominada ecuación BWR. 
La modelización matemática BWR aproxima al comportamiento real de los gases cuando la densidad es menor que 2,5 veces la densidad reducida:
δ < 2,5δr ó
ρ < 2,5ρr , siendo ρ ó δ la inversa del volumen específico ν de la ecuación. Es por eso que también se la puede encontrar de la siguiente forma:
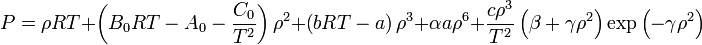
La modelización BWR es una ampliación de la Modelización Beattie-Bridgeman que plantea una ecuación de 5 constantes. La ecuación BWR tiene 8 constantes:

Ecuación de BWRS

- ρ = densidad molar
Los valores de los parámetros para quince sustancias pueden encontrarse en:
K.E. Starling, Fluid Properties for Light Petroleum Systems. Gulf Publishing Company (1973).
Elliott, Suresh, Donohue
La ecuación de estado de Elliott, Suresh, y Donohue (ESD) fue propuesta en
1990. Pretende corregir una desviación de la ecuación de estado de Peng-Robinson, en la cual existe una imprecisión en el término de repulsión de van der Waals. La ecuación tiene en cuenta el efecto de la forma de las moléculas apolares y puede extenderse a polímeros añadiendo un término extra (no se muestra). La ecuación fue desarrollada a partir de simulaciones informáticas y comprende la física esencial del tamaño, forma y puente de hidrógeno.
Donde:
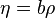
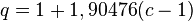

Bibliografía: Elliott & Lira, Introductory Chemical Engineering Thermodynamics, 1999, Prentice Hall.
Ecuación de Bose ideal
http://es.wikipedia.org/wiki/Ecuaci%C3%B3n_de_estado
![\operatorname{pH} = -\log[H^+] \,\!](http://upload.wikimedia.org/math/5/d/2/5d200556969ae3c6d320c3e9f7b67680.png)


![\mbox{pH} = -\log_{10} \left[ \mbox{a}_{H_3O^+} \right]](http://upload.wikimedia.org/math/7/b/7/7b7e772992e9d43888cd421cba60c766.png)




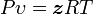

 donde νi es el volumen específico molar ideal y νr el volumen específico molar real (medido). La expresión anterior sirve también para hallar z usando el volumen específico calculado con el modelo ideal y el calculado con otro de los modelos matemáticos.
donde νi es el volumen específico molar ideal y νr el volumen específico molar real (medido). La expresión anterior sirve también para hallar z usando el volumen específico calculado con el modelo ideal y el calculado con otro de los modelos matemáticos.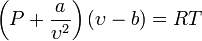


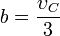

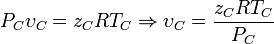

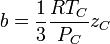



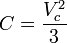




 = constante de los gases (8.31451 J/mol·K)
= constante de los gases (8.31451 J/mol·K)



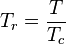
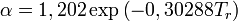


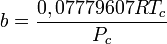




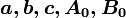

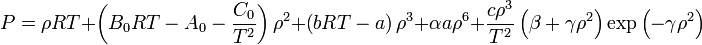 La modelización BWR es una ampliación de la Modelización Beattie-Bridgeman que plantea una ecuación de 5 constantes. La ecuación BWR tiene 8 constantes:
La modelización BWR es una ampliación de la Modelización Beattie-Bridgeman que plantea una ecuación de 5 constantes. La ecuación BWR tiene 8 constantes: